伦理会简介
北京安贞医院临床研究伦理委员会简介
北京安贞医院临床研究伦理委员会负责审查由本院医药专业技术人员任主要研究者的涉及人体的注册目的药物和医疗器械临床试验。
伦理委员会通过临床试验管理系统(CTMS)进行受理及审查。对研究方案的审查类别分为初始审查、复审审查和跟踪审查。其中跟踪审查包括:修正审查、研究进展审查、安全性报告审查、严重不良事件审查、方案偏离审查、暂停/终止研究审查和总结报告审查。审查方式包括:会议审查、快速审查和紧急会议审查。
申请人在向伦理委员会提交申请之前,请确认您已经通过药物临床试验机构的形式审查。已经通过机构形式审查的试验,请及时递交伦理审查申请,您的将会安排在最近一次的伦理会议。会议召开的频率为每月1-2次。
临床试验管理系统(CTMS)使用流程如下:
①CRA申请CTMS账号,使用该账号填报申请,向主要研究者(PI)发起申请。上传文件不要求加盖红章,请务必上传能够检索内容的PDF版方案和知情同意书。
②PI使用CTMS审核并确认,向伦理委员会发起申请;
③伦理办公室工作人员在CTMS中对申请进行形式审查,如需要修改,将通过CTMS将修改意见反馈至申请人,由申请人修改后再次递交。直至工作人员确认申请内容无误,将通知申请人递交纸质文件;
④在CTMS导出申请表并打印,请PI签字;在接待日,将纸质文件递交至办公室。秘书审查CTMS和纸质文件的完整性和一致性后受理。
⑤申请人可在CTMS中查阅审查进度、审查意见,并可在线查阅/下载书面审查意见的扫描件。
⑥申请人应及时在CTMS系统反馈缴费凭证。
申请要求请详见《临床研究伦理审查申请指南》,如有疑问请邮件或电话联系。
请关注微信公众号@北京安贞GCP平台,了解临床试验相关管理指南。
伦理会办公室联系人:杨克旭、宋天天
电话:(010)6442-6153
邮件:EC@anzhenGCP.com
安全性报告邮箱:SAE@anzhenGCP.com
微信公众号@北京安贞GCP平台
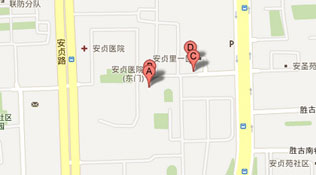
地址:北京市朝阳区安贞路2号北京安贞医院门诊楼4层滚梯西侧伦理办公室
接待:递交文件随时投递至办公室门口文件箱并扫码登记;接待日一般为周四全天,请关注伦理群通知








.jpg)